Η σοβαρή ατοπική δερματίτιδα βρήκε την θεραπεία της
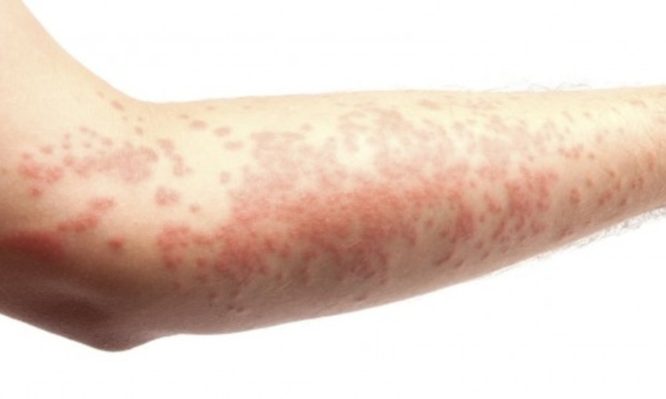
Η ατοπική δερματίτιδα, μία μορφή εκζέματος, αποτελεί μία χρόνια φλεγμονώδη νόσο με συμπτώματα που συχνά παρουσιάζονται ως εξάνθημα στην επιφάνεια του δέρματος. Η μέτρια έως σοβαρή ατοπική δερματίτιδα χαρακτηρίζεται από εξανθήματα, που συχνά καλύπτουν μεγάλο τμήμα του σώματος, και είναι δυνατό να συνοδεύεται από έντονο, συνεχή κνησμό και ξηρότητα, σκάσιμο, ερυθρότητα, δημιουργία εφελκίδων και εξιδρώματος. Ο κνησμός είναι ένα από τα πιο δύσκολα συμπτώματα των ασθενών που ενδέχεται να καταστεί εξουθενωτικό. Επιπλέον, οι ασθενείς με μέτρια έως σοβαρή ατοπική δερματίτιδα παρουσιάζουν μειωμένη ποιότητα ζωής, που περιλαμβάνει διαταραχές ύπνου, καθώς και συμπτώματα αυξημένου άγχους και κατάθλιψης εξαιτίας της νόσου.
«Οι ασθενείς με μέτρια έως σοβαρή ατοπική δερματίτιδα είναι δυνατό να παρουσιάσουν αφόρητα συμπτώματα που ενδέχεται να έχουν σημαντικό αντίκτυπο στην ποιότητα ζωής τους. Πολλοί από αυτούς συνήθως προσπαθούν να ελέγξουν τη νόσο με τις διαθέσιμες θεραπευτικές επιλογές,» δήλωσε η κα Christine Janus, Chief Executive Officer International Alliance of Dermatology Patient Organizations. «Υποστηρίζουμε την έγκαιρη πρόσβαση σε αυτό το νέο σημαντικό φάρμακο για όσους ασθενείς πάσχουν από μέτρια έως σοβαρή ατοπική δερματίτιδα προκειμένου να έχουν τη δυνατότητα να ρυθμίστουν και να ανακουφιστούν από αυτή τη συχνά άκρως εξουθενωτική χρόνια νόσο που αλλάζει τη ζωή τους.»
Το dupilumab είναι ένα ανθρώπινο μονοκλωνικό αντίσωμα που έχει σχεδιαστεί για να αναστέλλει την υπερενεργή σηματοδότηση δύο βασικών κυτοκινών, της IL-4 και της IL-13, οι οποίες πιστεύεται ότι αποτελούν σημαντικό παράγοντα της επίμονης υποκείμενης φλεγμονής στην ατοπική δερματίτιδα και σε ορισμένες άλλες αλλεργικές ή ατοπικές νόσους.[8],[9] Το dupilumab θα διατίθεται σε προγεμισμένη σύριγγα και θα μπορεί να χορηγείται υποδορίως από τον ίδιο τον ασθενή κάθε δεύτερη βδομάδα μετά από μία αρχική δόση φόρτισης. Το dupilumab μπορεί να χρησιμοποιείται με ή χωρίς τοπικά κορτικοστεροειδή.8
«Αυτή η έγκριση του dupilumab στην Ευρώπη καταδεικνύει την προσέγγισή μας στην προσφορά καινοτόμων νέων θεραπειών για όσους έχουν σημαντικές ανεκπλήρωτες ιατρικές ανάγκες. Η σημερινή έγκριση αποτελεί ένα σημαντικό ορόσημο για τους ανθρώπους που ζουν με μέτρια έως σοβαρή ατοπική δερματίτιδα στην Ευρώπη,» δήλωσε ο κος Elias Zerhouni, M.D., President, Global R&D της Sanofi. «Το dupilumab στοχεύει στην υποκείμενη αιτία της ατοπικής δερματίτιδας, βοηθά στην κάθαρση του δέρματος, τη διαχείριση του επίμονου εξουθενωτικού κνησμού και τη βελτίωση της συνολικής ποιότητας ζωής. Εστιάζουμε πλέον στην όσο το δυνατό ταχύτερη διάθεση αυτής της σημαντικής νέας θεραπευτικής επιλογής για τους ανθρώπους στην Ευρώπη που ζουν με αυτή τη συστηματική νόσο.»
Μετά την παραχώρηση αυτής της άδειας κυκλοφορίας, η Sanofi και η Regeneron θα συνεργαστούν με τις αρμόδιες τοπικές αρχές για τη διάθεση του dupilumab στους ασθενείς που το έχουν ανάγκη στις χώρες ανά την Ευρώπη.
«Το dupilumab αντιπροσωπεύει την κορύφωση δεκαετιών επιστημονικής έρευνας στη βιολογία αλλεργικών νόσων όπως η μέτρια έως σοβαρή ατοπική δερματίτιδα,» δήλωσε ο κος George D. Yancopoulos, M.D., Ph.D., President, και Chief Scientific Officer της Regeneron. «Συνεχίζουμε να αξιολογούμε τις δυνατότητες του dupilumab στη θεραπεία της ατοπικής δερματίτιδας σε παιδιά και εφήβους, καθώς και σε αλλεργικές φλεγμονώδεις νόσους που σχετίζονται με το μονοπάτι των κυτοκινών IL-4/IL-13.»
Το dupilumab έχει εγκριθεί στις ΗΠΑ για τη θεραπεία ενηλίκων ασθενών με μέτρια έως σοβαρή ατοπική δερματίτιδα (έκζεμα) των οποίων η νόσος δεν ελέγχεται επαρκώς με συνταγογραφούμενες θεραπείες που εφαρμόζονται τοπικά στο δέρμα ή στην περίπτωση που οι συγκεκριμένες θεραπείες δεν ενδείκνυνται. Το dupilumab μπορεί να χρησιμοποιείται με ή χωρίς τοπικά κορτικοστεροειδή. Δεν είναι γνωστό εάν το dupilumab είναι ασφαλές και αποτελεσματικό για χρήση σε παιδιά.[10]
Κλινικό πρόγραμμα LIBERTY AD και Αποτελέσματα
Η έγκριση του dupilumab βασίστηκε σε στοιχεία από το παγκόσμιο κλινικό πρόγραμμα LIBERTY AD, στο οποίο συμμετείχαν περίπου 3.000 ασθενείς. Οι κλινικές μελέτες του προγράμματος LIBERTY AD είναι οι εξής: SOLO 1, SOLO 2, CHRONOS, SOLO-CONTINUE και CAFÉ. Οι μελέτες εξέτασαν τη χρήση του dupilumab είτε ως μονοθεραπεία (SOLO 1, SOLO 2 και SOLO-CONTINUE) είτε σε συνδυασμό με τοπικά κορτικοστεροειδή (CHRONOS ή CAFÉ) σε ασθενείς με μέτρια έως σοβαρή ατοπική δερματίτιδα οι οποίοι δεν ελέγχονταν επαρκώς με συνταγογραφούμενες θεραπείες τοπικής εφαρμογής ή ανοσοκατασταλτικά φάρμακα, όπως η κυκλοσπορίνη, ή στην περίπτωση που οι συγκεκριμένες θεραπείες δεν ενδείκνυντο. Σε όλες τις μελέτες, το dupilumab ως μονοθεραπεία ή σε συνδυασμό με τοπικά κορτικοστεροειδή πέτυχε τα πρωτεύοντα και κύρια δευτερεύοντα καταληκτικά σημεία Οι πιο συχνά αναφερόμενες ανεπιθύμητες ενέργειες που παρατηρήθηκαν σε υψηλότερο ποσοστό σε σχέση με το εικονικό φάρμακο στην ομάδα θεραπείας με dupilumab (> 1%) ήταν αντιδράσεις στο σημείο έγχυσης, φλεγμονή του οφθαλμού και του βλεφάρου, που περιλαμβάνει ερυθρότητα, οίδημα και κνησμό, καθώς και ψυχρά έλκη στο στόμα ή τα χείλη.
Επισκόπηση του Προγράμματος για το dupilumab
Επί του παρόντος, το dupilumab αξιολογείται στο πλαίσιο ενός ολοκληρωμένου προγράμματος ανάπτυξης για την ατοπική δερματίτιδα το οποίο περιλαμβάνει μελέτες σε παιδιά με σοβαρή ατοπική δερματίτιδα (ηλικίας 6 μηνών έως 11 ετών) και σε έφηβους με μέτρια έως σοβαρή ατοπική δερματίτιδα (ηλικίας 12 έως 17 ετών). Οι δυνητικές αυτές χρήσεις βρίσκονται υπό δοκιμή και η ασφάλεια και αποτελεσματικότητά τους δεν έχουν αξιολογηθεί ή επιβεβαιωθεί από καμία ρυθμιστική αρχή.
Το dupilumab αξιολογείται επίσης για άλλες φλεγμονώδεις νόσους στις οποίες πιστεύεται ότι οι κυτοκίνες IL- 4 και IL-13 αποτελούν σημαντικό παράγοντα, μεταξύ των οποίων το επίμονο μη ελεγχόμενο άσθμα (Φάσης 3), η ρινική πολυποδίαση (Φάσης 3) και ηωσινοφιλική οισοφαγίτιδα (Φάσης 2). Οι δυνητικές αυτές χρήσεις βρίσκονται υπό δοκιμή και η ασφάλεια και αποτελεσματικότητά τους δεν έχουν αξιολογηθεί από καμία ρυθμιστική αρχή. Το dupilumab αναπτύσσεται από κοινού από τη Regeneron και τη Sanofi στο πλαίσιο μίας συμφωνίας παγκόσμιας συνεργασίας.